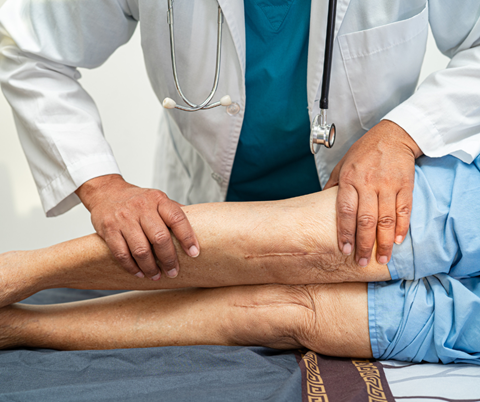
La dehiscencia de una herida quirúrgica es una complicación que puede ocurrir después de una cirugía, y se refiere a la separación de los bordes de una incisión antes de que la cicatrización esté completa.
Esta condición puede ser parcial, afectando solo las capas superficiales, o completa, donde todas las capas de tejido se separan, exponiendo incluso órganos internos en casos severos.
Causas de la dehiscencia de heridas
Las causas de la dehiscencia de una herida quirúrgica pueden incluir
- Problemas técnicos: Fallos en las suturas, grapas o adhesivos utilizados para cerrar la herida.
- Tensión mecánica: Movimientos bruscos, tos o estornudos que ejercen presión sobre la incisión.
- Interrupción del proceso de cicatrización: Infecciones, mala circulación o condiciones médicas subyacentes que impiden la correcta cicatrización.
Síntomas de la dehiscencia
Los síntomas pueden variar dependiendo de la gravedad de la dehiscencia, pero comúnmente incluyen
- Dolor en el área de la incisión.
- Hinchazón o enrojecimiento.
- Secreción de la herida.
- Separación visible de los bordes de la incisión.
Tratamiento eficaz de la dehiscencia
El tratamiento de la dehiscencia de una herida quirúrgica debe ser inmediato y puede incluir
- Limpieza y desbridamiento: Es esencial limpiar la herida y eliminar cualquier tejido muerto o infectado para prevenir complicaciones adicionales.
- Re-sutura: En casos severos, puede ser necesario volver a suturar la herida para asegurar que los bordes se mantengan juntos.
- Uso de apósitos avanzados: Apósitos que mantienen un ambiente húmedo y protegen la herida pueden acelerar la cicatrización.
- Antibióticos: Si hay una infección presente, el uso de antibióticos tópicos o sistémicos puede ser necesario.
- Terapia de Presión Negativa: Esta técnica puede ayudar a reducir el edema y promover la formación de tejido granulado.
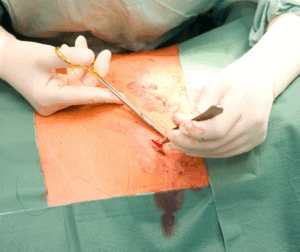
Prevención de la dehiscencia
Para prevenir la dehiscencia de una herida quirúrgica, es importante seguir las recomendaciones postoperatorias del médico, evitar movimientos bruscos y mantener una buena higiene de la herida.
Además, controlar las condiciones médicas subyacentes y mantener una nutrición adecuada puede mejorar significativamente las posibilidades de una cicatrización exitosa.
Conclusión
La dehiscencia de una herida quirúrgica es una complicación seria que requiere atención médica inmediata. En Urgo Medical, estamos comprometidos a proporcionar las mejores soluciones y productos para el cuidado de heridas, ayudando a nuestros pacientes a lograr una cicatrización óptima y mejorar su calidad de vida.